O que é um ponto Isoeletrico?
Índice
- O que é um ponto Isoeletrico?
- Como saber a carga de um aminoácido?
- Qual a carga dos aminoácidos?
- Qual é a carga elétrica líquida do aminoácido em solução com pH abaixo e acima do seu Isoelétrico?
- O que é ponto Isoloelétrico como pode ser calculado?
- O que é o ponto isoelétrico da Caseina?
- Como calcular a carga de um peptídeo?
- O que é pKa e pI de um aminoácido?
- Como os aminoácidos funcionam como Zwitterion?
- Qual é o ponto isoelétrico da lisina?
- Qual é o pH do aminoácido?
- Como são produzidos os aminoácidos não padrão?
- Qual o papel do aminoácido na proteína?
- Como os aminoácidos podem participar da formação de pontes de hidrogênio?
O que é um ponto Isoeletrico?
O ponto onde a carga líquida total da molécula de aminoácido ou proteína é nula é tão importante, que recebeu uma denominação especial. Assim, o valor de pH onde existe equivalência entre as cargas positivas e negativas da molécula é denominado PONTO ISOELÉTRICO.
Como saber a carga de um aminoácido?
e) Ponto isoelétrico (pI): A carga elétrica total de uma proteína é dada pelo somatório das cargas dos R dos aminoácidos, as quais dependem, por sua vez, dos pkas e do pH do meio.
Qual a carga dos aminoácidos?
Os restantes aminoácidos apresentam estereoisómeros verificando-se que é incorporado em proteínas o isómero levógiro (L). Dependendo do grupo funcional, as cadeias laterais podem ser alifáticas, aromáticas, ácidas (carga negativa) , básicas (carga positiva) ou polares.
Qual é a carga elétrica líquida do aminoácido em solução com pH abaixo e acima do seu Isoelétrico?
Ponto isoelétrico, ponto isoeléctrico ou pI, é o valor de pH onde uma molécula, por exemplo, um aminoácido ou uma proteína, apresenta carga elétrica líquida igual a zero. ... O pI é o pH no qual há equilíbrio entre as cargas negativas e positivas dos grupamentos iônicos de um aminoácido ou de uma proteína.
O que é ponto Isoloelétrico como pode ser calculado?
Ponto Isoelétrico (pI) é o pH em que um aminoácido, polipetídeo ou proteína tem uma carga líquida igual a zero (0). Para sistemas simples, o valor do pI pode ser calculado na seguinte forma: a) Identificar as formas iônicas da molécula que tem cargas líquidas –1, 0 e +1.
O que é o ponto isoelétrico da Caseina?
pH=4,7 O ponto isoelétrico da caseína é em pH=4,7(5). Nessas circunstâncias ela se encontra na forma mais apolar, ou seja, apresenta baixa solubilidade, precipitando em relação ao sistema.
Como calcular a carga de um peptídeo?
Como calcular a carga liquida de um peptideo
- 1° Passo: Você deve ter um desenho da sequência do peptídeo de acordo com seus compostos.
- 2° Passo: Após ter a sequência, você somará a carga dos compostos. Preste sempre atenção, pois onde a molécula é neutra as cargas positivas e negativas viram iguais.
- Espero ter ajudado.
O que é pKa e pI de um aminoácido?
Figura 15 – Equação de pKb e relação pKa e pKb. Figura 16 – Variações do grupo amino dos aminoácidos. O pK corresponde ao pH em que há 50% de dissociação do ácido ou da base. ... O pI é o pH no qual há equilíbrio entre as cargas negativas e positivas dos grupamentos iônicos de um aminoácido ou de uma proteína.
Como os aminoácidos funcionam como Zwitterion?
Aminoácidos são anfóteros, moléculas anfipróøcas, podendo doar ou receber prótons (H+) de acordo com o conceito ácido- base de Brönsted-Lowry; pH fisiológico → íon dipolar, denominado zwitterion, formado com a protonação do grupo amino pelo ácido carboxílico.
Qual é o ponto isoelétrico da lisina?
Lisina
| Lisina Alerta sobre risco à saúde | |
|---|---|
| Ponto de fusão | 224–225 °C (base livre, enantiômero, decompõe-se) 263–264 °C (monocloridrato) 260-263 °C (monocloridrato de DL-lisina) 193 °C (dicloridrato de L-lisina) 187-189 °C (dicloridrato de DL-lisina) |
| Acidez (pKa) | pKCOOH : 2,20 pKα-NH3+ : 8,90 pKε-NH3+ : 10,28 |
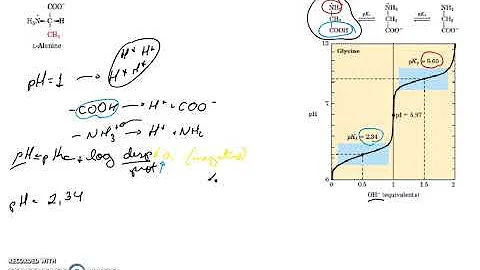
Qual é o pH do aminoácido?
- Valor de pH onde o aminoácido apresenta carga elétrica líquida igual a zero; pI é o pH no qual há equilíbrio entre as cargas negavas e posiWvas dos grupamentos iônicos de um aminoácido ou de uma proteína. Curva de titulação da glicina Ponto Isoelétrico (PI)
Como são produzidos os aminoácidos não padrão?
- Aminoácidos não padrão são produzidos por modificações químicas dos aminoácidos-padrão [ver pág. 45]). Cada aminoácido apresenta um grupo carboxila, um grupo amino primário (exceto a prolina, que possui um grupo amino secundário) e uma cadeia lateral que o distingue dos demais (o “grupo R”), todos ligados ao átomo de carbono .
Qual o papel do aminoácido na proteína?
- Nas proteínas, quase todos esses grupos carboxila e amino estão combinados nas ligações peptídicas e, em geral, não estão disponíveis para reações químicas, exceto pela possibilidade de formação de ligações de hidrogênio (Fig. 1.1B). Portanto, em última análise, é a natureza dessas cadeias laterais que determina o papel do aminoácido na proteína.
Como os aminoácidos podem participar da formação de pontes de hidrogênio?
- Os aminoácidos serina, treonina e tirosina contêm grupos hidroxila que podem participar da formação de pontes de hidrogênio(*). (*) Resultam da atração eletrostática entre um átomo eletronegativo (normalmente O ou N) e um átomo de hidrogênio ligado covalentemente a um segundo átomo eletronegativo.















