Como ocorre a formação dos orbitais moleculares?
Índice
- Como ocorre a formação dos orbitais moleculares?
- Como são formadas as ligações π e π * Pela tom?
- Como é formada a ligação na TLV?
- Como saber se uma molécula existe?
- Como os orbitais atômicos se tornam ligantes?
- Quais os tipos de orbitais moleculares?
- Quais os orbitais híbridos dos carbonos utilizados para formar as ligações covalentes indicadas nas estruturas?
- Como ocorre a promoção de elétrons no carbono para formar 4 ligações?
- O que é TLV na química?
- Como a teoria de ligação de Valencia explica a formação de uma ligação covalente?
- Quais as caracteristicas dos orbitais moleculares?
- Quais são os orbitais?
- Quando foi descoberta a teoria dos orbitais moleculares?
- Quais são os orbitais resultantes da combinação?
Como ocorre a formação dos orbitais moleculares?
O orbital molecular é formado quando ocorre a interpenetração entre orbitais incompletos de átomos com a tendência de ganhar elétrons. Dois elétrons na camada de valência (como o hélio). ...
Como são formadas as ligações π e π * Pela tom?
Os orbitais sigma formam a ligação σ. O mesmo vale para as ligações π, formadas por orbitais π (pi): OM π*, para antiligante e OM π, para ligante. ... Com isso, originam ligações com simetria sigma (σ) ou com simetria pi (π). Portanto, os orbitais p podem originar ligações σ e ligações π, conforme as figuras abaixo.
Como é formada a ligação na TLV?
De acordo com a TLV: As ligações são formadas quando os orbitais dos átomos se superpõem. Para que esta superposição ocorra existem dois elétrons de spins contrários. A sobreposição ocorre à medida que os núcleos se aproximam.
Como saber se uma molécula existe?
Para saber se uma molécula existe ou se é paramagnética basta utilizar o diagrama de população, e aplicar a equação de O.L.
Como os orbitais atômicos se tornam ligantes?
Os orbitais py formam orbitais π ligantes quando somados e π* anti- ligantes quando subtraídos. O mesmo vale para os orbitais px. Outro aspecto importante a ser considerado é a energia relativa dos orbitais moleculares formados em relação aos orbitais atômicos originais.
Quais os tipos de orbitais moleculares?
A teoria dos orbitais moleculares usa uma combinação linear de orbitais atômicos para representar orbitais moleculares envolvendo toda a molécula. Estes são frequentemente divididos em orbitais ligantes, anti-ligantes e não-ligantes.
Quais os orbitais híbridos dos carbonos utilizados para formar as ligações covalentes indicadas nas estruturas?
O carbono sp pode fazer duas ligações sigma usando os orbitais híbridos e duas ligação pi usando os orbitais 2px e 2py, como ocorre nos átomos de carbono do etino e no átomo central do propadieno.
Como ocorre a promoção de elétrons no carbono para formar 4 ligações?
O carbono realiza apenas quatro ligações porque sofre o fenômeno da hibridização, pois o número de ligações que um átomo realiza está diretamente relacionado com o número de orbitais incompletos. Como em um átomo de carbono existem apenas dois orbitais incompletos, ele deveria fazer fazer apenas 2 ligações.
O que é TLV na química?
De acordo com a teoria de ligação de valência (TLV), a ligação entre dois átomos é conseguida através da sobreposição de dois orbitais atômicos semipreenchidos. Sobreposição refere-se a uma porção destes orbitais atômicos que ocupam o mesmo espaço.
Como a teoria de ligação de Valencia explica a formação de uma ligação covalente?
Segundo a Teoria da Ligação de Valência: As ligações entre os átomos são formadas pela sobreposição de orbitais atômicos. Um par de elétrons de spins opostos situado entre um par de átomos constitui uma ligação.
Quais as caracteristicas dos orbitais moleculares?
- CARACTERISTICAS DOS ORBITAIS MOLECULARES - OM - Podem ser construídos como uma combinação linear de OA (CLOA). - Energias definidas. - Princípio de exclusão de Pauli: cada OM pode ser ocupado por até dois elétrons. - Se dois elétrons estão presentes, então seus spins devem estar emparelhados (↑↓).
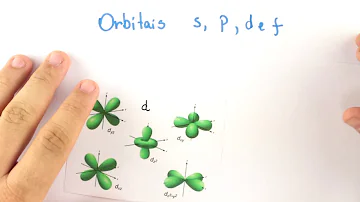
Quais são os orbitais?
- Os orbitais são regiões na eletrosfera do átomo em que é máxima a probabilidade de se encontrar o elétron, ou a função de onda que descreve o movimento de um elétron. Os orbitais são representados por nuvens eletrônicas e são diferentes para cada tipo de ligação; assim, para uma ligação do tipo s temos um orbital esférico; e para uma ligação p, ...
Quando foi descoberta a teoria dos orbitais moleculares?
- O maior sucesso da teoria dos orbitais moleculares foi quando provou que esta é paramagnética, ou seja, ela é influenciada fortemente pela energia eletromagnética. Quando este é submetido a um campo magnéticoele é atraído como se fosse um metal sendo atraído por ímã, porém em menor intensidade.
Quais são os orbitais resultantes da combinação?
- Após a combinação o AOs deixam de existir tornando-se OMs, e por conseguinte os orbitais resultantes devem ser preenchido por spins da mesma maneira, que preenchemos orbitais aos quais estamos habituados, seguindo procedimento de Aufbau que orienta a distribuir por sequência e não aos pares em cada orbital.















